Трансгенные животные. Справка — РИА Новости, 30.06.2010
https://ria.ru/20100630/251341203.html
Трансгенные животные. Справка
Трансгенные животные. Справка — РИА Новости, 30.06.2010
Трансгенные животные. Справка
— это экспериментально полученные животные, содержащие во всех клетках своего организма дополнительную интегрированную с хромосомами чужеродную ДНК (трансген),… РИА Новости, 30.06.2010
2010-06-30T17:15
2010-06-30T17:15
2010-06-30T17:15
/html/head/meta[@name=’og:title’]/@content
/html/head/meta[@name=’og:description’]/@content
https://cdnn21.img.ria.ru/images/sharing/article/251341203.jpg?1277903743
РИА Новости
1
5
4.7
96
7 495 645-6601
ФГУП МИА «Россия сегодня»
https://xn--c1acbl2abdlkab1og.xn--p1ai/awards/
2010
РИА Новости
1
5
4.7
96
7 495 645-6601
ФГУП МИА «Россия сегодня»
https://xn--c1acbl2abdlkab1og. xn--p1ai/awards/
xn--p1ai/awards/
Новости
ru-RU
https://ria.ru/docs/about/copyright.html
https://xn--c1acbl2abdlkab1og.xn--p1ai/
РИА Новости
1
5
4.7
96
7 495 645-6601
ФГУП МИА «Россия сегодня»
https://xn--c1acbl2abdlkab1og.xn--p1ai/awards/
РИА Новости
1
5
4.7
96
7 495 645-6601
ФГУП МИА «Россия сегодня»
https://xn--c1acbl2abdlkab1og.xn--p1ai/awards/
РИА Новости
1
5
4.7
96
7 495 645-6601
ФГУП МИА «Россия сегодня»
https://xn--c1acbl2abdlkab1og.xn--p1ai/awards/
справки
Справки
Трансгенные животные — это экспериментально полученные животные, содержащие во всех клетках своего организма дополнительную интегрированную с хромосомами чужеродную ДНК (трансген), которая передается по наследству.
Термин «трансгеноз» был предложен в 1973 г. для обозначения переноса генов одних организмов в клетки организмов других видов, в том числе далеких в эволюционном отношении. Получение трансгенных животных осуществляется с помощью переноса клонированных генов (ДНК) в ядра оплодотворенных яйцеклеток (зигот) или эмбриональных стволовых (плюрипотентных) клеток. Затем в репродуктивные органы реципиентной (получающей) самки пересаживают модифицированные зиготы или яйцеклетки, у которых собственное ядро заменено на модифицированное ядро эмбриональных стволовых клеток, либо бластоцисты (эмбрионы), содержащие чужеродную ДНК эмбриональных стволовых клеток.
Первые трансгенные животные были получены в 1974 г. в Кембридже (США) Рудольфом Янишем (Rudolph Jaenisch) в результате инъекции в эмбрион мыши ДНК вируса обезьяны SV40. В 1980 г. американским ученым Жоржем Гордоном (Gordon) с соавторами было предложено использовать для создания трансгенных животных микроинъекцию ДНК в пронуклеус (ядро в яйцеклетке) зиготы. Именно этот подход положил начало широкому распространению технологии получения трансгенных животных. В России первые трансгенные животные появились в 1982 г. С помощью микроинъекций в пронуклеус зиготы в 1985 г. в США были получены первые трансгенные сельскохозяйственные животные (кролик, овца, свинья).
Именно этот подход положил начало широкому распространению технологии получения трансгенных животных. В России первые трансгенные животные появились в 1982 г. С помощью микроинъекций в пронуклеус зиготы в 1985 г. в США были получены первые трансгенные сельскохозяйственные животные (кролик, овца, свинья).
Все имеющиеся методы переноса генов (трансгеноз) пока еще не очень эффективны. Для получения одного трансгенного животного в среднем необходимы микроинъекции ДНК в 40 зигот мышей, 90 зигот козы, 100 зигот свиньи, 110 зигот овцы и в 1600 зигот коровы.
При трансгенозе могут возникать неожиданные проблемы. Одна из первых работ по генетической транформации животных проводились путем встраивания генов гормона роста. Перенос гена гормона роста крысы мышам увеличивал рост мышей в 2 раза. Эксперименты по трансгенозу генов гормона роста быка кроликам также увенчались успехом. А вот аналогичные эксперименты по модификации крупного рогатого скота привели к увеличению прироста всего на 10 20%.
Технология создания трансгенных животных является одной из наиболее бурно развивающихся биотехнологий в последние 10 лет. Трансгенные животные широко используются как для решения большого числа теоретических задач, так и в практических целях для биомедицины и сельского хозяйства.
Уже получены трансгенные коровы и козы, в молоке которых содержится человеческий белок лактоферрин.
Американская корпорация Genzyme Transgenics проводит исследования с целью создания трансгенного крупного рогатого скота, содержащего в молоке человеческий альбумин. Альбумин используется в терапии для поддержания осмотического давления в крови. Genzyme Transgenics занимается разработкой аналогичных методов получения человеческого гормона роста и β интерферона.
В Англии созданы трансгенные овцы, молоко которых содержит фактор свертывания крови.
В России получены свиньи, несущие ген соматотропина. Они не отличались по темпам роста от нормальных животных, но изменение обмена веществ сказалось на содержании жира. Такие трансгенные свиньи были созданы для изучения цепочки биохимических превращений гормона, а побочным эффектом явилось укрепление иммунной системы.
Такие трансгенные свиньи были созданы для изучения цепочки биохимических превращений гормона, а побочным эффектом явилось укрепление иммунной системы.
Трансгенных животных получают и для целей ксенотрансплантации (пересадки органов человеку). Одним из излюбленных доноров органов являются свиньи, так как имеется анатомическое сходство органов и сходство иммунологических свойств. Реакции отторжения при трансплантации имеют сложный механизм. Одним из сигналов для атаки организма на чужой орган являются белки, локализованные на внешней поверхности мембраны. У трансгенных свиней эти белки заменены на человеческие.
Существует множество трансгенных животных, моделирующих различные заболевания человека (рак, атеросклероз, ожирение и др.).
В практических целях трансгенные животные используются различными зарубежными фирмами как коммерческие биореакторы, обеспечивающие производство разнообразных медицинских препаратов (антибиотиков, факторов свертываемости крови и др.). Кроме того, перенос новых генов позволяет получать трансгенных животных, отличающихся повышенными продуктивными свойствами (например, усиление роста шерсти у овец, понижение содержания жировой ткани у свиней, изменение свойств молока) или устойчивостью к различным заболеваниям, вызываемым вирусами и другими патогенами. В настоящее время человечество уже использует множество продуктов, получаемых с помощью трансгенных животных: медицинские препараты, органы, пища.
В настоящее время человечество уже использует множество продуктов, получаемых с помощью трансгенных животных: медицинские препараты, органы, пища.
Материал подготовлен на основе информации открытых источников
Трансгенные животные | Наука и жизнь
Успехи генетики, молекулярной биологии и других биологических наук дали ученым возможность работать с изолированными генами высших организмов. Можно выделять гены, выяснять некоторые механизмы их работы и конструировать новые, гибридные гены, не существующие в природе. Такие гены можно вводить в клетки бактерий и высших организмов, и они способны встраиваться в наследственный аппарат клеток. А дальше можно получить животных, содержащих в каждой клетке чужеродные гены. В конце 70-х и начале 80-х годов в некоторых лабораториях мира и Советского Союза были начаты работы по введению чужеродных генов в оплодотворенные яйцеклетки мыши как наиболее доступного и генетически изученного объекта. Животные, содержащие чужеродные гены, получили название трансгенных. В настоящее время уже имеются некоторые успехи в получении трансгенных мышей и их использовании для решения тех или иных биологических задач. Об этих работах рассказывают научные сотрудники Л. С. Попов (Институт молекулярной генетики АН СССР) и Л. Г Эшкинд (ВНИИбиотехнологии), ведущие исследования в этой области.
В настоящее время уже имеются некоторые успехи в получении трансгенных мышей и их использовании для решения тех или иных биологических задач. Об этих работах рассказывают научные сотрудники Л. С. Попов (Институт молекулярной генетики АН СССР) и Л. Г Эшкинд (ВНИИбиотехнологии), ведущие исследования в этой области.
Нормальная и карликовая мыши.
Нормальная мышь рядом с трансгенной мышью, в геном которой ввели гормон роста.
Схема получения трансгенных мышей. В изолированную хирургическим путем уже оплодотворенную яйцеклетку вводятся гены. Эту клетку подсаживают ложнобеременной, то есть предварительно спаренной со стерильным самцом, самке. Она становится приемной матерью. Из выведенных искусственно яйцеклеток рождается потомство. Поскольку не все мышата получают чужеродный ген, необходим молекулярный анализ их генома для подлинного выявления трансгенности.
Действие трансгена. Возможные сочетания половых клеток (яйцеклеток и сперматозоидов) при оплодотворении приводят к образованию четырех типов зигот.
‹
›
Открыть в полном размере
В начале 80-х годов группа ученых США и Швеции впервые получила мышей-великанов. Это был результат введения гена гормона роста крысы в оплодотворенные яйцеклетки мыши. И выросшая из этого зародыша мышь-великан оказалась почти в два раза больше обычной. Но главный результат опыта заключался в том, что трансгенная мышь росла в два раза быстрее, чем обычная.
Вы можете спросить: зачем нам ускорять рост мышей? Вот если бы куры или коровы росли в короткий срок, то это было бы более полезным для людей.
Действительно, неплохо было бы научиться разводить в сокращенный срок полезных для человека птиц и животных.
Каким же образом удалось ученым ускорить рост мышей? Одним из основных стимуляторов роста и деления клеток у животных и человека является гормон роста. Образуется он обычно в гипофизе. Ученые решили проверить, как будет вести себя чужеродный гормон роста в организме мыши. Структурный ген этого гормона ввели в яйцеклетку. Получили потомство, и оказалось, что гормон крысы вырабатывался в сердце, почках, печени и кишечнике, но не в гипофизе. При этом количество гормона в крови повышалось в несколько сотен раз по сравнению с нормальными мышами. Очевидно, поэтому некоторые мыши и вырастали великанами.
Такие же манипуляции были проделаны с более отдаленным родственником — геном гормона роста человека. Мыши и в этом случае росли ускоренно. Более того, обнаружился удивительный факт: несмотря на то, что гормон роста человека содержит почти в три раза больше аминокислот, чем гормон роста крысы, это не влияло на усиленный рост мышей — оба гормона действовали с равной силой.
Конечно, здесь еще много сложностей: как обычно, ответы на первые вопросы ставят новые вопросы, и ответа на них пока нет. Но хочется обратить внимание читателей на то, что в крови трансгенных мышей резко увеличивается количество гормона роста. Это открывает возможность использовать трансгенных животных в качестве биологической фабрики гормона роста человека, то есть появляется выход в биотехнологию, способную конкурировать с обычной микробиологической фабрикой. При этом надо помнить, что мышь — всего лишь объект исследования, а сырьем для биологической фабрики может служить кровь более крупных трансгенных животных (овцы, свиньи, кролика и др.).
Одной из главных проблем биологии, решение которой, пожалуй, не обойдется без использования трансгенных животных, является проблема дифференцировки клеток. В зародыше организма все клетки поначалу одинаковы, но в ходе развития они становятся клетками мышц, костей, нервов, сердца, печени и других органов и тканей. Иными словами, в ходе развития организма клетки получают специальность. Но как именно это происходит, науке пока неизвестно. Проблема между тем громадная и чрезвычайно важная, ибо речь идет о том, чтобы понять суть эмбрионального развития, когда из одной клетки развивается столь сложный организм, как тело млекопитающих и особенно человека.
Иными словами, в ходе развития организма клетки получают специальность. Но как именно это происходит, науке пока неизвестно. Проблема между тем громадная и чрезвычайно важная, ибо речь идет о том, чтобы понять суть эмбрионального развития, когда из одной клетки развивается столь сложный организм, как тело млекопитающих и особенно человека.
Еще в начале нашего века эмбриологи экспериментаторы пытались выяснить это с помощью микроманипуляций, разрушая некоторые эмбриональные клетки гонкими иглами или пересаживая участки ткани от одного раннего эмбриона другому. Подобные методы сохранили свое значение и поныне при изучении пространственной организации клеток, обусловливающей возникновение отдельных органов или тканей. Однако эти методы, как и обычные биохимические методы с использованием очищенных молекул в пробирке, не позволяют сделать прямых выводов относительно молекулярных основ регуляции работы генов,
Для решения проблемы дифференцировки ученые часто используют культуры клеток и тканей. Но ответ на вопрос, какие молекулярные механизмы заставляют клетки дифференцироваться, и на этой модели не получен. Ее недостаток состоит в том, что культивируемые клетки изолированы от организма. У них нет контакта с клетками других тканей, а такой контакт (взаимодействие клеток, обмен сигналами) необходим, ибо он индуцирует дифференцировку и эмбриональное развитие. Вывод напрашивается сам: изучать молекулярные механизмы дифференцировки клеток и раннего эмбрионального развития надо на живом организме. Именно поэтому большие надежды возлагаются на живые модели — трансгенных животных.
Но ответ на вопрос, какие молекулярные механизмы заставляют клетки дифференцироваться, и на этой модели не получен. Ее недостаток состоит в том, что культивируемые клетки изолированы от организма. У них нет контакта с клетками других тканей, а такой контакт (взаимодействие клеток, обмен сигналами) необходим, ибо он индуцирует дифференцировку и эмбриональное развитие. Вывод напрашивается сам: изучать молекулярные механизмы дифференцировки клеток и раннего эмбрионального развития надо на живом организме. Именно поэтому большие надежды возлагаются на живые модели — трансгенных животных.
Но как эту модель использовать? Напомним, что для получения трансгенных животных нужны гены. Однако для конкретной цели нужны, очевидно, соответствующие ей гены. Какие же из них связаны с дифференцировкой?
В последние годы ученым удалось выявить некоторые гены-регуляторы, которые принимают участие в реализации программы развития организма. Их называют хроногенами, так как, по мнению ученых, они играют основную роль в определении момента начала дифференцирован клеток данного организма.
Наиболее интересные наблюдения были получены при изучении генов, контролирующих пространственную организацию эмбриона плодовой мушки дрозофилы. Оказалось, что многие гены содержат один и тот же сегмент ДНК, названный гомеобоксом, и все они обладают способностью регулировать активность групп других генов. Заметим, что в настоящее время гомеобокс выделен из ДНК многих организмов — от червей до человека.
Нельзя умолчать об онкогенах, которые обнаружены в нормальных клетках большинства организмов (от дрожжей до млекопитающих). Ученые предполагают, что онкогены не только порождают опухоли, но и участвуют в дифференцировке эмбриональных клеток. Основанием такого предположения послужили некоторые факты. Так, например, было выяснено, что для поддержания роста и деления клеток раннего эмбриона необходимы факторы роста. Но у раннего эмбриона еще нет тканей, способных вырабатывать эти факторы, поэтому можно думать, что каждая клетка раннего эмбриона производит их для самой себя и, возможно, для своего ближайшего окружения.
Итак, ученые имеют сейчас в своем «хозяйстве» ряд замечательных последовательностей ДНК в виде хроногенов, сегмента гомеобокса и онкогенов, которые причастны к дифференцировке клеток в эмбриональном развитии. Их можно вводить в геном будущих трансгенных животных и изучать их действие во время роста ранних эмбрионов. По-видимому, это дает ключ, который позволит проникнуть в тайны молекулярных механизмов развития высших животных.
Кроме того, введение изолированного онкогена в геном здорового животного дает и другую возможность — изучать отдельно стадии образования опухолей и наследственную предрасположенность к их возникновению. Иными словами, создавать модели течения опухолевых заболеваний.
Создание экспериментальных моделей течения болезней открывает новые направления и перед практической медициной, в частности лечением наследственных заболеваний. В настоящее время насчитывается около трех тысяч наследственных заболеваний. Некоторые из них могут быть следствием нарушения сложных регуляторных систем организма. Большинство же связано с нехваткой ферментов. В качестве примера можно назвать фенилкетонурию, врожденную непереносимость лактозы, подагру, гемолитическую анемию и многие другие.
Терапия таких заболеваний, казалось бы, проста — ввел в организм недостающий фермент и жди улучшения. Однако действует фермент недолго, и приходится делать больному систематические инъекции. Можно использовать ограничение пищевого рациона, чтобы снизить в организме концентрацию вредных веществ. Эти способы довольно успешно используются, но справедливости ради следует сказать, что излечение редко бывает полным. Поэтому в повестку дня встала так называемая генная терапии, то есть методы введения в больные клетки недостающего гена или замены дефектного гена нормальным.
Однако действует фермент недолго, и приходится делать больному систематические инъекции. Можно использовать ограничение пищевого рациона, чтобы снизить в организме концентрацию вредных веществ. Эти способы довольно успешно используются, но справедливости ради следует сказать, что излечение редко бывает полным. Поэтому в повестку дня встала так называемая генная терапии, то есть методы введения в больные клетки недостающего гена или замены дефектного гена нормальным.
Дело это оказалось непростым. Прежде всего необходимо иметь нормальный ген. Сейчас их уже научились получать. Для доставки нормального гена в дефектные клетки требуется «повозка». В этой роли ученые решили использовать вирусы. Хотя эта идея не нова, она до последних нескольких лет оставалась нереализованной. Наиболее пригодными оказались опухолевые вирусы, геном которых состоит из РНК (ретровирусы). Эти вирусы отличаются тем, что не убивают клетки подобно другим вирусам. С помощью генной инженерии нужно было превратить исходный вирус в вирус-повозку, функция которого заключалась бы только в доставке нужного гена в клетку и встраивании его в клеточные хромосомы. Молекулярные биологи из Массачусетского технологического института (США) сконструировали такой вирус. Затем «нагрузили» его бактериальным геном устойчивости к антибиотику и ввели эту нагруженную повозку в кроветворные клетки костного мозга мыши. Анализ показал, что все типы клеток крови экспериментальной мыши приобрели этот перенесенный бактериальный ген.
Молекулярные биологи из Массачусетского технологического института (США) сконструировали такой вирус. Затем «нагрузили» его бактериальным геном устойчивости к антибиотику и ввели эту нагруженную повозку в кроветворные клетки костного мозга мыши. Анализ показал, что все типы клеток крови экспериментальной мыши приобрели этот перенесенный бактериальный ген.
Теоретически этот метод уже можно применить к генотерапии наследственных заболеваний крови людей. Однако технические проблемы, связанные с регулированием работы перенесенных генов, не позволяют пока это делать. Исследования продолжаются.
Другой способ генотерапии связан с половыми клетками. Группа исследователей использовала его совсем недавно. В качестве объекта они взяли карликовую мышь, которая может служить моделью наследственного заболевания человека. У такой мыши отставание в росте заметно с пятидневного возраста, а взрослые животные достигают приблизительно половины нормальной мыши. Поскольку введение гена гормона роста восстанавливало рост, то ученые решили исправить карликовость с помощью генной терапии. Сначала они вводили в яйцеклетку карликовой мыши чистые гены гормона роста крысы или человека. Рост не восстанавливался. Когда же они ввели в яйцеклетку дополнительно ген-регулятор, то карликовая мышь вырастала до нормальной. Казалось бы, такой успех можно перенести на лечение подобного заболевания у людей. Но придется разочаровать читателей: делать этого пока нельзя. Причин несколько. Одна из них связана с низкой эффективностью техники гемотерапии. Во-первых, только один процент яйцеклеток с введенным чужим геном развивается в мышь, у которой усилено действие гормона роста. Во-вторых, пока практически невозможно предвидеть, в какое место встроится чужеродная молекула ДНК, и потому-то невозможно гарантированно заменить поврежденный ген нормальным. Более того, вводимый ген может попасть «не туда» и разрушить какой-нибудь нормальный ген, то есть даст результат, обратный желаемому.
Сначала они вводили в яйцеклетку карликовой мыши чистые гены гормона роста крысы или человека. Рост не восстанавливался. Когда же они ввели в яйцеклетку дополнительно ген-регулятор, то карликовая мышь вырастала до нормальной. Казалось бы, такой успех можно перенести на лечение подобного заболевания у людей. Но придется разочаровать читателей: делать этого пока нельзя. Причин несколько. Одна из них связана с низкой эффективностью техники гемотерапии. Во-первых, только один процент яйцеклеток с введенным чужим геном развивается в мышь, у которой усилено действие гормона роста. Во-вторых, пока практически невозможно предвидеть, в какое место встроится чужеродная молекула ДНК, и потому-то невозможно гарантированно заменить поврежденный ген нормальным. Более того, вводимый ген может попасть «не туда» и разрушить какой-нибудь нормальный ген, то есть даст результат, обратный желаемому.
Таким образом, эти примеры показывают, что использовать предлагаемые способы для лечения больных людей еще невозможно.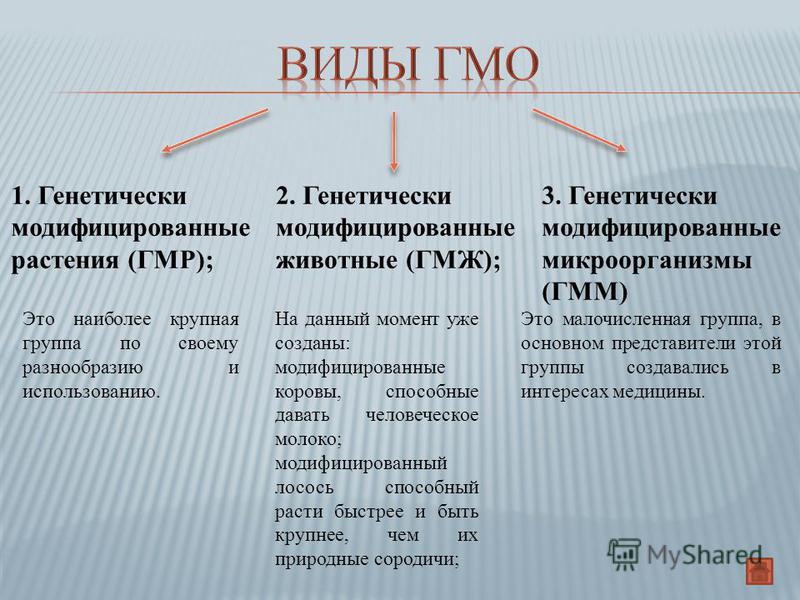 Чтобы вмешиваться в наследственность человека, по крайней мере необходимо знать полностью генотип человека. Наука пока далека от этого. Однако первые успехи на этом пути, хотя и очень малые, воодушевляют ученых на дальнейшие поиски.
Чтобы вмешиваться в наследственность человека, по крайней мере необходимо знать полностью генотип человека. Наука пока далека от этого. Однако первые успехи на этом пути, хотя и очень малые, воодушевляют ученых на дальнейшие поиски.
Наконец, еще одна область возможного использования трансгенных животных — это повышение количества и качества продукции сельскохозяйственных животных. Так, сам по себе ускоренный рост трансгенных животных, видимо, позволяет увеличить выход мяса. Но, кроме того, есть ведь и возможность (пока теоретическая, конечно) ввести, скажем, в корову ген необходимого продукта и заставить его работать в молочных железах, а продукты гена выделять потом из молока. Со временем люди научатся получать таким образом лекарственные препараты — интерферон, инсулин, гормон роста и другие нужные вещества. Словом, сельскохозяйственные животные смогут нести те или иные конструкции генов и превратятся в живые фабрики биологически и химически важных пептидов и белков.
Все это звучит сейчас слишком фантастично, однако фантазия нередко переходит в реальность. И кто знает, может быть, для людей будущего станут обычными названия специализированных хозяйств — например, совхоз «сахарных» коров, то есть трансгенных коров, молоко которых содержит большое количество сахара.
И кто знает, может быть, для людей будущего станут обычными названия специализированных хозяйств — например, совхоз «сахарных» коров, то есть трансгенных коров, молоко которых содержит большое количество сахара.
С другой стороны, техника получения трансгенных животных, видимо, может помочь быстрее переносить полезные свойства одной породы к другой, то есть ускорить выведение новых высокопродуктивных пород животных. Это откроет невиданные горизонты перед сельскохозяйственной генетикой и селекцией.
Как видим, можно констатировать, что биология вступила в период реального воплощения заветной мечты человечества— направленного изменения высших организмов. Не за горами будущее — конструирование геномов животных и растений.
Однако тут обычно возникает очень серьезный вопрос, интересующий, кстати, многих наших читателей: не опасны ли генноинженерные манипуляции с ДНК для человека, животных и растений? Ведь в результате таких манипуляций могут появиться организмы с совершенно новыми генетическими качествами, ранее не существовавшими на Земле. И если они выйдут каким-либо образом из-под контроля, распространятся в природе, то это может вызвать нежелательные изменения в генетическом аппарате земных организмов — врожденные пороки, уродства и т. п.
И если они выйдут каким-либо образом из-под контроля, распространятся в природе, то это может вызвать нежелательные изменения в генетическом аппарате земных организмов — врожденные пороки, уродства и т. п.
Поэтому еще на заре генной инженерии, в середине 70-х годов, группа исследователей обратилась к ученым всего мира с призывом наложить мораторий на генетические эксперименты в наиболее опасных для человека направлениях исследований. А затем, в феврале 1975 года, в США была созвана международная конференция, на которой присутствовало 140 ученых из 17 стран, в том числе и из Советского Союза. Работе этой конференции стала первым в истории мировой науки примером принятия мер предосторожности до, а не после того, как возникла опасность: на ней был объявлен запрет ни проведение особо опасных экспериментов до разработки соответствующих мер предосторожности.
После конференции исследования по генной инженерии были несколько переориентированы. В качестве объектов для генетических манипуляций были взяты только те микроорганизмы, которые неспособны населять кишечный тракт человека, не выживают в половых клетках и легко уничтожаются обычными моющими средствами.
Затем в нашей стране (так же, как и в других странах) были приняты правила безопасности работ с рекомбинантными (составными) молекулами ДНК. У нас эти правила согласованы с Министерством здравоохранения СССР и ВЦСПС и являются обязательными для всех, имеющих дело с генной инженерией.
В чем же заключаются эти правила? Они, в частности, включают некоторые общие требования безопасности: работу необходимо проводить в специальной одежде и специальными инструментами, не разрешается курить, хранить и принимать пищу в рабочих помещениях, отходы, содержащие рекомбинантные молекулы, помещаются в специальную посуду и обеззараживаются и т. д.
Кроме того, применяются меры физической и биологической защиты различных степеней — в зависимости от величины предполагаемой опасности эксперимента. Так, средний уровень физической защиты (ФЗ) требует проводить эксперименты в лаборатории, имеющей специальные инженерные конструкции, герметичное помещение и защитное оборудование. Воздух из лаборатории выводится по самостоятельным воздуходувам после очистки на фильтрах. Работа с открытыми сосудами, в которых содержится материал с носителем рекомбинантных ДНК, обязательно проводится в боксах с пониженным давлением. Лабораторную одежду нельзя носить вне лаборатории ФЗ, она должна обеззараживаться до отправки в прачечную. Перед выходом из лаборатории персонал обязан мыть руки с использованием дезинфицирующих средств и т. д.
Воздух из лаборатории выводится по самостоятельным воздуходувам после очистки на фильтрах. Работа с открытыми сосудами, в которых содержится материал с носителем рекомбинантных ДНК, обязательно проводится в боксах с пониженным давлением. Лабораторную одежду нельзя носить вне лаборатории ФЗ, она должна обеззараживаться до отправки в прачечную. Перед выходом из лаборатории персонал обязан мыть руки с использованием дезинфицирующих средств и т. д.
Высший уровень физической Защиты (Ф4) применяется к работам с микроорганизмами, потенциально опасными для человека, животных и растений. Эксперименты могут проводиться только в помещениях особой конструкции — в отдельном здании или в полностью изолированном от других помещений отсеке общего здания. Инженерные особенности такой лаборатории: монолитные стены, полы и потолки, в которых все технические отверстия (для воздушных каналов, электропроводки, трубопроводных коммуникаций) герметизируются. Лаборатория должна иметь отдельную вентиляционную систему, поддерживающую отрицательное давление воздуха до выхода его в атмосферу, воздушные шлюзы, через которые могут безопасно доставляться в помещение предметы оборудования, посуда, животные и материалы. Вход в лабораторию разрешается только тем лицам, чье присутствие предусмотрено программой исследования. Работы должны выполняться в боксах с вытяжной вентиляцией и фильтрами. Доступ в эти боксы возможен лишь из рабочих помещений лаборатории.
Вход в лабораторию разрешается только тем лицам, чье присутствие предусмотрено программой исследования. Работы должны выполняться в боксах с вытяжной вентиляцией и фильтрами. Доступ в эти боксы возможен лишь из рабочих помещений лаборатории.
Важным элементом правил являются биологические меры защиты, разрешающие использовать только такие микроорганизмы, биологические свойства которых исключают их распространение и выживание в окружающей среде. В частности, категорически запрещается использовать для получения рекомбинантных молекул ДНК бактерии и вирусы, патогенные для человека, сельскохозяйственных животных и растений. Тем более не разрешается преднамеренное введение в рекомбинантные молекулы генов, заведомо опасных для здоровья и благополучия человека, и преднамеренное распространение новых рекомбинантных молекул в окружающей среде. (Здесь перечислена, понятно, только часть защитных мер. При желании с ними можно подробней познакомиться в книге «Итоги науки и техники. Молекулярная биология», том 12, часть II, Москва, 1980 г. , стр. 199.)
, стр. 199.)
Надо сказать, что со временем — по мере накопления знаний и развития техники генной инженерии — потенциальная опасность подобных экспериментов оказалась преувеличенной, и сейчас правила работы с рекомбинантными молекулами пересматриваются с целью снятия некоторых ограничений. Это позволит расширить возможности исследований — при прежнем, максимальном уровне езопасности.
Определение и значение трансгена — Merriam-Webster
транс · ген ˈtran(t)s-ˌjēn
ˈtranz-
: ген, взятый из генома одного организма и искусственно введенный в геном другого организма
Примеры предложений
Недавние примеры в Интернете
Опять же, самцы изменены, на этот раз с трансгеном для фермента, разрезающего ДНК. — Джефф Уилрайт, Discover Magazine , 20 февраля 2015 г.
Борьба с вредителями и борьба с устойчивостью путем выпуска насекомых, несущих самцов селекции трансген .
— Кристи Уилкокс, Discover Magazine , 16 июля 2015 г.
Но гибриды не содержат трансгена и, таким образом, не являются генетически модифицированными комарами.
— Бет Моул, Ars Technica , 2 октября 2019 г.
Команда не обнаружила комаров, несущих трансгенов , чужеродных для A. aegypti, которые Oxitec ввел для уничтожения потомства и флуоресцентной маркировки комаров как ГМ.
— Келли Сервик, 9 лет.0013 Наука | AAAS , 1 октября 2019 г.
— Джефф Уилрайт, Discover Magazine , 20 февраля 2015 г.
Борьба с вредителями и борьба с устойчивостью путем выпуска насекомых, несущих самцов селекции трансген .
— Кристи Уилкокс, Discover Magazine , 16 июля 2015 г.
Но гибриды не содержат трансгена и, таким образом, не являются генетически модифицированными комарами.
— Бет Моул, Ars Technica , 2 октября 2019 г.
Команда не обнаружила комаров, несущих трансгенов , чужеродных для A. aegypti, которые Oxitec ввел для уничтожения потомства и флуоресцентной маркировки комаров как ГМ.
— Келли Сервик, 9 лет.0013 Наука | AAAS , 1 октября 2019 г.
Эти примеры программно скомпилированы из различных онлайн-источников, чтобы проиллюстрировать текущее использование слова «трансген». Любые мнения, выраженные в примерах, не отражают точку зрения Merriam-Webster или ее редакторов. Отправьте нам отзыв об этих примерах.
Любые мнения, выраженные в примерах, не отражают точку зрения Merriam-Webster или ее редакторов. Отправьте нам отзыв об этих примерах.
История слов
Первое известное использование
1984 год, в значении, определенном выше
Путешественник во времени
Первое известное использование трансгена было в 1984 году
Посмотреть другие слова того же года трансгендерный
трансген
трансгенный
Посмотреть другие записи поблизости
Процитировать эту запись «Трансген».
Словарь Merriam-Webster.com , Merriam-Webster, https://www.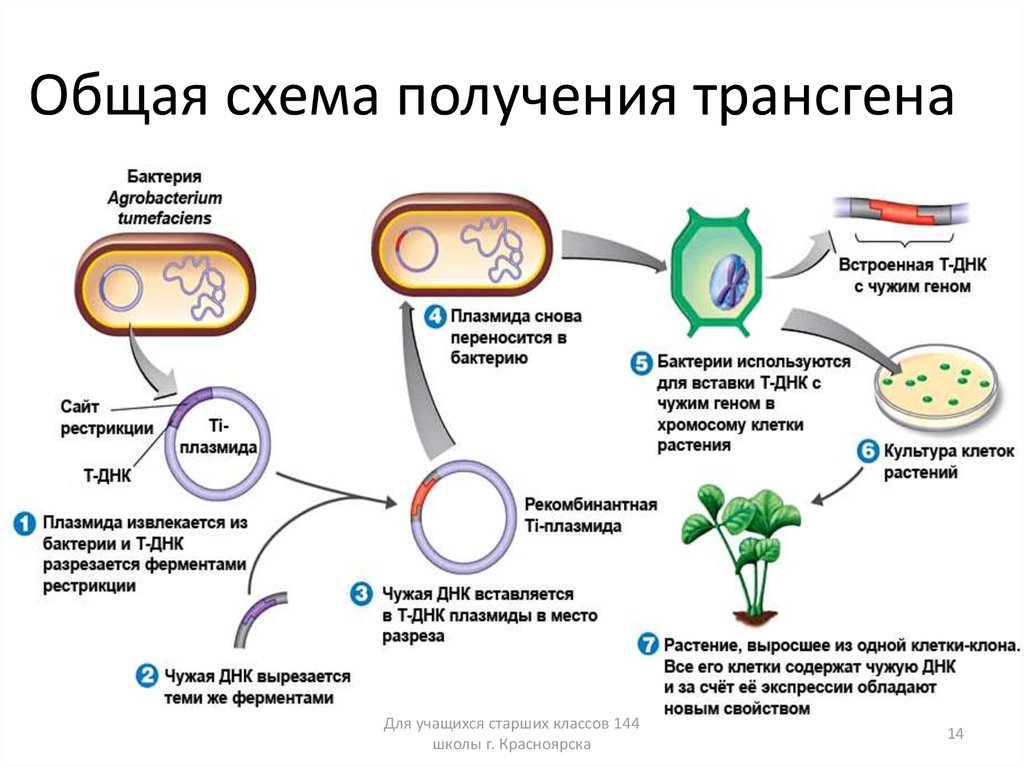 merriam-webster.com/dictionary/transgene. По состоянию на 4 апреля 2023 г.
merriam-webster.com/dictionary/transgene. По состоянию на 4 апреля 2023 г.Копия цитирования
Медицинское определение
трансген
существительное
транс · ген ˈtran(t)s-ˌjēn ˈtranz-
: ген, взятый из генома одного организма и введенный в геном другого организма искусственными методами
Подпишитесь на крупнейший словарь Америки и получите тысячи дополнительных определений и расширенный поиск без рекламы!
Merriam-Webster без сокращений
запоздалый
См. Определения и примеры »
Определения и примеры »
Получайте ежедневно по электронной почте Слово дня!
Как ты меня только что назвал?
- Перед тем, как мы пошли к ней домой, Ханна сказала нам, что ее тетя была флиббертигиббет .
- Оскорбление Бесплатный
Прослушайте слово и напечатайте его. Сколько вы можете получить правильно?
ПРОЙДИТЕ ТЕСТ
Сможете ли вы составить 12 слов из 7 букв?
ИГРАТЬ
Поток трансгенов: факты, предположения и возможные контрмеры
1.
Телем Р.С., Вани С.Х., Сингх Н.Б., Нандини Р., Садхухан Р., Бхаттачарья С., Мандал Н. Цисгеникс — устойчивый подход к улучшению урожая. Карр Геномикс
2013; 14:468-76; PMID: 24396278; http://dx. doi.org/ 10.2174/13892029113146660013 [бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
doi.org/ 10.2174/13892029113146660013 [бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
2. Холм И.Б., Вендт Т., Холм П.Б. Интрагенез и цисгенез как альтернатива развитию трансгенных культур. Завод Биотехнолог J 2013; 11:395-407; PMID: 23421562; http://dx.doi.org/10.1111/pbi.12055 [PubMed] [CrossRef] [Google Scholar]
3. Мэллори-Смит С., Запиола М. Поток генов из устойчивых к глифосату культур. Наука о борьбе с вредителями 2008 г.; 64:428-40; PMID: 18181145; http://dx.doi.org/10.1002/ps.1517 [PubMed] [CrossRef] [Google Scholar]
4. Девос Ю., Диллен К., Демонт М. Как гибкость может быть интегрирована в правила сосуществования? Обзор. J Sci Food Agric 2014; 94:381-7; PMID: 23965758; http://dx.doi.org/10.1002/jsfa.6358 [PubMed] [CrossRef] [Google Scholar]
5. Демеке Т., Перри Д.Дж., Скоукрофт В.Р. Случайное присутствие ГМО: научный обзор канадского зерна. Can J Plant Sci 2006 г.; 86:1-23; http://dx.doi.org/10.4141/P05-114 [CrossRef] [Google Scholar]
6. Spök A, Twyman RM, Fischer R, Ma JK, Sparrow PA. Эволюция нормативно-правовой базы для фармацевтических препаратов, полученных из генетически модифицированных растений. Тенденции Биотехнологии
2008 г.; 26:506-17; PMID: 18676047; http://dx.doi.org/10.1016/j.tibtech.2008.05.007 [PubMed] [CrossRef] [Google Scholar]
Spök A, Twyman RM, Fischer R, Ma JK, Sparrow PA. Эволюция нормативно-правовой базы для фармацевтических препаратов, полученных из генетически модифицированных растений. Тенденции Биотехнологии
2008 г.; 26:506-17; PMID: 18676047; http://dx.doi.org/10.1016/j.tibtech.2008.05.007 [PubMed] [CrossRef] [Google Scholar]
7. Шёненбергер Н., Д’Андреа Л. Изучение распространения генетически модифицированной устойчивой к глифосату Brassica napus L. (Brassicaceae) на швейцарских железных дорогах. Окружающая среда. Научная Европа 2012 г.; 24:23; http://www.enveurope.com/content/24/1/23 [Google Scholar]
8. Hecht M, Oehen B, Schulze J, Brodmann P, Bagutti C. Обнаружение одичавшего трансгенного рапса GT73 (Brassica napus) вдоль железнодорожных путей на подъездных путях к заводам по производству масличных культур в Швейцарии. Environ Sci Pollut Res 2014; 21:1455-65; PMID: 23917737; http://dx.doi.org/10.1007/s11356-013-1881-9 [PubMed] [CrossRef] [Google Scholar]
9.
Холл Л., Топинка К. , Хаффман Дж., Дэвис Л., Гуд А.
Поток пыльцы между устойчивыми к гербицидам Brassica napus является причиной множественной устойчивости добровольцев B-napus. Наука о сорняках
2000 г.; 48:688-94; WOS:000166182800008; http://dx.doi.org/10.1614/0043-1745(2000)048[0688:PFBHRB]2.0.CO;2 [CrossRef] [Google Scholar]
, Хаффман Дж., Дэвис Л., Гуд А.
Поток пыльцы между устойчивыми к гербицидам Brassica napus является причиной множественной устойчивости добровольцев B-napus. Наука о сорняках
2000 г.; 48:688-94; WOS:000166182800008; http://dx.doi.org/10.1614/0043-1745(2000)048[0688:PFBHRB]2.0.CO;2 [CrossRef] [Google Scholar]
10. Мэллори-Смит, Калифорния, Санчес Ольгин Э. Поток генов из устойчивых к гербицидам культур: это касается не только трансгенов. J Agric Food Chem 2011 г.; 59:5813-8; PMID: 21058724; http://pubs.acs.org/doi/abs/10.1021/jf103389v [PubMed] [CrossRef] [Google Scholar]
11. Ортис-Гарсия С., Эскурра Э., Шоэл Б., Асеведо Ф., Соберон Дж., Сноу А.А. Отсутствие обнаруживаемых трансгенов у местных местных сортов кукурузы в Оахаке, Мексика (2003–2004 гг.). Proc Natl Acad Sci U S A 2005 г.; 102:12338-43; PMID: 16093316; http://www.pnas.org/content/102/35/12338.long [бесплатная статья PMC] [PubMed] [Google Scholar]
12.
Шоэль Б., Фэган Дж. Недостаточно доказательств открытия трансгенов в мексиканских местных сортах.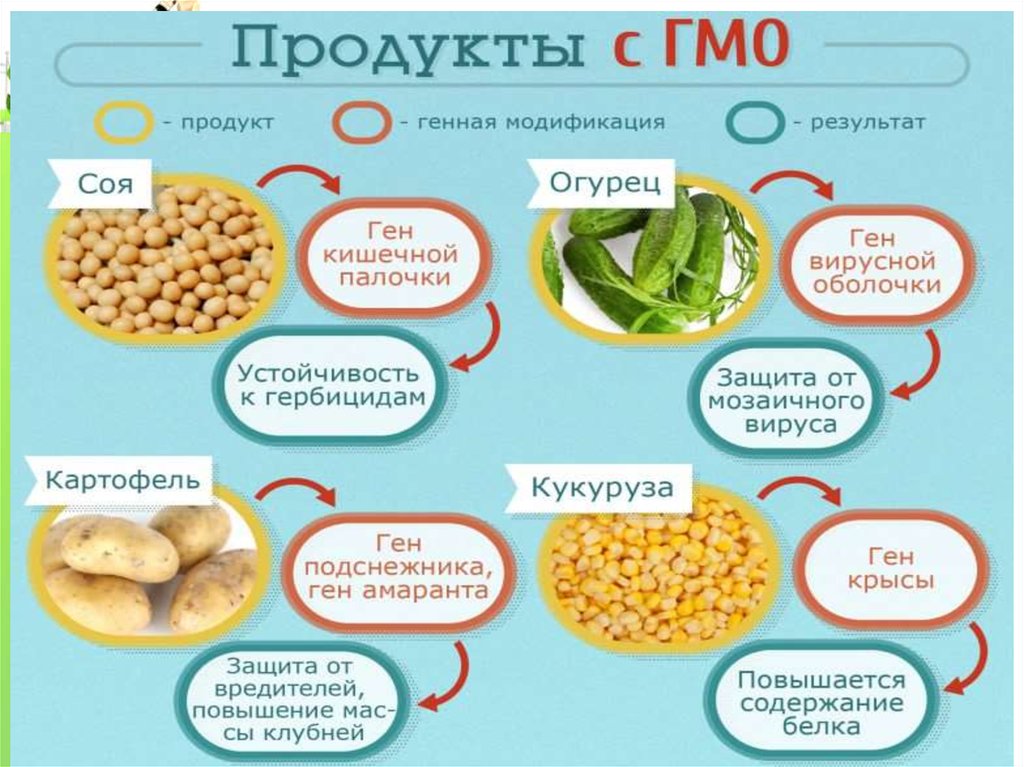 Мол Эколь
2009 г.; 18:4143-4; PMID: 19793201; http://dx.doi.org/10.1111/j.1365-294X.2009.04368.x [PubMed] [CrossRef] [Google Scholar]
Мол Эколь
2009 г.; 18:4143-4; PMID: 19793201; http://dx.doi.org/10.1111/j.1365-294X.2009.04368.x [PubMed] [CrossRef] [Google Scholar]
13. Пинейро-Нельсон А., Ван Херваарден Дж., Пералес Х.Р., Серратос-Эрнандес Дж.А., Рангель А., Хаффорд М.Б., Гептс П., Гарай-Арройо А., Ривера-Бустаманте Р., Альварес-Буйлла Э.Р. Разрешение спора об обнаружении трансгенов в Мексике: источники ошибок и научная практика в коммерческом и экологическом контекстах. Мол Эколь 2009 г.; 18:4145-50; PMID: 19143938; http://dx.doi.org/10.1111/j.1365-294Х.2008.03993.х [CrossRef] [Google Scholar]
14. Дайер Г.А., Серратос-Эрнандес Х.А., Пералес Х.Р., Гептс П., Пиньейро-Нельсон А., Чавес А., Салинас-Арреортуа Н., Юнес-Науд А., Тейлор Х.Е., Альварес-Буйлла Э.Р. Распространение трансгенов через системы семян кукурузы в Мексике. ПЛОС ОДИН 2009 г.; 4:е5734; PMID: 19503610; http://www.plosone.org/article/info%3Adoi%2F10.1371%2Fjournal.pone.0005734 [бесплатная статья PMC] [PubMed] [Google Scholar]
15. Асеведо Ф., Уэрта Э., Бургефф С., Колефф П., Сарухан Дж. Действительно ли трансгенная кукуруза нужна Мексике?
Нат Биотехнолог
2011 г.; 29:23-4; PMID: 21221094; http://dx.doi.org/10.1038/nbt.1752 [PubMed] [CrossRef] [Google Scholar]
Асеведо Ф., Уэрта Э., Бургефф С., Колефф П., Сарухан Дж. Действительно ли трансгенная кукуруза нужна Мексике?
Нат Биотехнолог
2011 г.; 29:23-4; PMID: 21221094; http://dx.doi.org/10.1038/nbt.1752 [PubMed] [CrossRef] [Google Scholar]
16. Паррот В. Генетически модифицированные мифы и реальность. Новая биотехнология 2010 г.; 27:545-51; PMID: 20609417; http://dx.doi.org/10.1016/j.nbt.2010.05.016 [PubMed] [CrossRef] [Google Scholar]
17. Вегир А., Пинейро-Нельсон А., Аларкон Дж., Гальвез-Марискаль А., Варез-Буйлла Э.Р., Пинеро Д. Недавний дальний поток трансгенов в дикие популяции соответствует историческим закономерностям потока генов у хлопчатника (Gossypium hirsutum) в его центре источник. Мол Эколь 2011 г.; 20:4182-94; PMID: 21899621; http://dx.doi.org/10.1111/j.1365-294X.2011.05258.x [PubMed] [CrossRef] [Google Scholar]
18.
Пракаш С., Кирос С.Ф., Кирти П.Б., Чопра В.Л.
brassica и ее близкие союзники: цитогенетика и эволюция. Обзоры селекции растений
2009 г.; 31:21-187; http://dx. doi.org/10.1002/9780470593783.ch3 [CrossRef] [Google Scholar]
doi.org/10.1002/9780470593783.ch3 [CrossRef] [Google Scholar]
19. Миккельсен Т.Р., Андерсен Б., Йоргенсен Р.Б. Риск распространения трансгена сельскохозяйственных культур. Природа 1996 год; 380:31; WOS: A1996TY87700040; http://www.nature.com/nature/journal/v380/n6569/pdf/380031a0.pdf [Google Scholar]
20. Сноу АА. Незаконный поток генов из трансгенной полевицы ползучей: сага продолжается. Мол Эколь 2012 г.; 21:4663-4; PMID: 23009646; http://dx.doi.org/10.1111/j.1365-294X.2012.05695.x [PubMed] [CrossRef] [Google Scholar]
21. Райхман Дж. Р., Ватруд Л. С., Ли Э. Х., Бердик К. А., Боллман М. А., Сторм М. Дж., Кинг Г. А., Мэллори-Смит С. Создание трансгенной устойчивой к гербицидам полевицы ползучей (Agrostis stolonifera L.) в неагрономических местообитаниях. Мол Эколь 2006 г.; 15:4243-55; PMID: 17054516; http://dx.doi.org/10.1111/j.1365-294X.2006.03072.x [PubMed] [CrossRef] [Google Scholar]
22.
Запиола М.Л., Мэллори-Смит, Калифорния. Пересечение водораздела: поток генов производит межродовой гибрид в дикой трансгенной популяции ползучей полевицы. Мол Эколь
2012 г.; 21:4672-80; PMID: 22625177; http://dx.doi.org/10.1111/j.1365-294X.2012.05627.x [PubMed] [CrossRef] [Google Scholar]
Мол Эколь
2012 г.; 21:4672-80; PMID: 22625177; http://dx.doi.org/10.1111/j.1365-294X.2012.05627.x [PubMed] [CrossRef] [Google Scholar]
23. Пирсолл Д. Сосуществование ГМ-культур: вопрос выбора, а не предрассудков. Корм ГМ-культур 2013; 4:4663-4: PMID: 23988874; http://dx.doi.org/10.4161/gmcr.26303 [PubMed] [CrossRef] [Google Scholar]
24. Kwit C, Moon HS, Warwick SI, Stewart CN, Jr. Интрогрессия трансгена у родственных культур: молекулярные данные и стратегии смягчения последствий. Тенденции Биотехнологии 2011 г.; 29:284-93; PMID: 21388698; http://dx.doi.org/10.1016/j.tibtech.2011.02.003 [PubMed] [CrossRef] [Google Scholar]
25.
Нандула В.К., Райт А.А., Молин В.Т., Рэй Дж.Д., Бонд Дж.А., Юбэнк Т.В. Амплификация EPSPS у устойчивого к глифосату колючего амаранта (Amaranthus spinosus): случай переноса генов посредством межвидовой гибридизации от устойчивого к глифосату амаранта Палмера (Amaranthus palmeri). Наука о борьбе с вредителями
2014; (Ранний просмотр), PMID: 24497375; http://dx. doi.org/10.1002/ps.3754
[PubMed] [CrossRef] [Google Scholar]
doi.org/10.1002/ps.3754
[PubMed] [CrossRef] [Google Scholar]
26. Уорик С.И., Бекки Х.Дж., Холл Л.М. Поток генов, инвазивность и экологическое воздействие генетически модифицированных культур. Энн Н.Ю. Академия наук 2009 г.; 1168:72-99; PMID: 19566704; http://dx.doi.org/10.1111/j.1749-6632.2009.04576.x [PubMed] [CrossRef] [Google Scholar]
27. Уилкинсон М., Тепфер М. Фитнес и не только: подготовка к появлению ГМ-культур с новыми экологически важными характеристиками. Экологическая биобезопасность Res 2009 г.; 8:1-14; PMID: 19419648; http://dx.doi.org/10.1051/ebr/2009003 [PubMed] [CrossRef] [Google Scholar]
28. Длугош К.М., Уиттон Дж. Можем ли мы помешать трансгенам прогуляться по дикой стороне? Мол Эколь 2008 г.; 17:1167-69; PMID: 18302682; http://dx.doi.org/10.1111/j.1365-294X.2008.03663.x [PubMed] [CrossRef] [Google Scholar]
29.
Сэмюэлс Дж.
Поток трансгенов из Bt brinjal: реальный риск? Тенденции Биотехнологии
2013; 31:332-4; PMID: 23706302; http://dx. doi.org/10.1016/j.tibtech.2013.03.007 [PubMed] [CrossRef] [Google Scholar]
doi.org/10.1016/j.tibtech.2013.03.007 [PubMed] [CrossRef] [Google Scholar]
30. Stewart CN, Jr., Halfhill MD, Warwick SI. Трансгенная интрогрессия от генетически модифицированных культур к их диким родственникам. Нат Рев Жене 2003 г.; 4:806-17; PMID: 14526376; http://dx.doi.org/10.1038/nrg1179 [PubMed] [CrossRef] [Google Scholar]
31. Wang W, Xia H, Yang X, Xu T, Si HJ, Cai XX, Wang F, Su J, Snow AA, Lu BR. Новый трансген синтазы 5-энолпирувоилшикимат-3-фосфата (EPSP) для устойчивости к глифосату стимулирует рост и плодовитость сорного риса (Oryza sativa) без гербицида. Новый Фитол 2013; 202:679-88; PMID: 23905647; http://dx.doi.org/10.1111/nph.12428 [бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
32.
Грессель Дж., Нил Стюарт С., младший, Гиддингс Л.В., Фишер А.Дж., Стрейбиг Дж.С., Бургос Н.Р., Тревавас А., Меротто А., младший, Ливер С.Дж., Амманн К. и др..
Сверхэкспрессия трансгена epsps в сорном рисе: недостаточно доказательств в поддержку предположений о биобезопасности.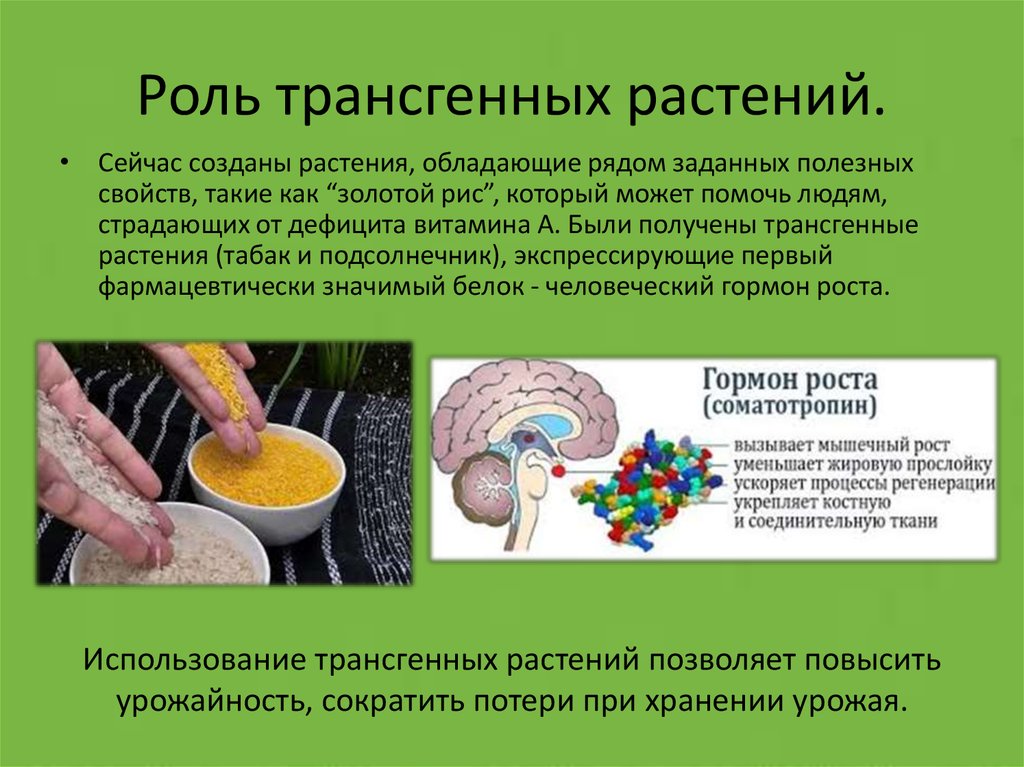 Новый Фитол
2014; 202:360-62; PMID: 24645782; http://dx.doi.org/10.1111/nph.12615 [PubMed] [CrossRef] [Google Scholar]
Новый Фитол
2014; 202:360-62; PMID: 24645782; http://dx.doi.org/10.1111/nph.12615 [PubMed] [CrossRef] [Google Scholar]
33. Грюневальд В., Бери Дж. Комментарий к «Новый трансген синтазы 5-енолпирувоилшикимат-3-фосфата (EPSP) для устойчивости к глифосату стимулирует рост и плодовитость сорного риса (Oryza sativa) без гербицида» Вана и соавт. (2014). Новый Фитол 2014; 202:367-69; PMID: 24645784; http://dx.doi.org/10.1111/nph.12683 [PubMed] [CrossRef] [Google Scholar]
34. Лу Б. Р., Сноу А. А., Ян X, Ван В. Использование одного трансгенного объекта для определения эффектов приспособленности гибридов сельскохозяйственных культур: ответ на письмо Grunewald & Bury (2014). Новый Фитол 2014; 202:370-72; PMID: 24645785; http://dx.doi.org/10.1111/nph.12748 [PubMed] [CrossRef] [Google Scholar]
35.
Лу Б.Р., Сноу А.А., Ян X, Ван В. Научные данные, опубликованные в рецензируемом журнале, следует правильно интерпретировать: ответ на письмо Gressel et al. (2014). Новый Фитол
2014; 202:363-66; PMID: 24645783; http://dx. doi.org/10.1111/nph.12684 [PubMed] [CrossRef] [Google Scholar]
doi.org/10.1111/nph.12684 [PubMed] [CrossRef] [Google Scholar]
36. Сноу А.А., Пилсон Д., Ризеберг Л.Х., Полсен М.Дж., Плескац Н., Реагон М.Р., Вольф Д.Е., Сельбо С.М. Трансген Bt снижает травоядность и повышает плодовитость диких подсолнухов. Приложение Ecol 2003 г.; 13:279-86; http://dx.doi.org/10.1890/1051-0761(2003)013[0279:ABTRHA]2.0.CO;2 [CrossRef] [Google Scholar]
37. Чепмен М.А., Берк Дж.М. Выпустить ген из бутылки: популяционная генетика генетически модифицированных культур. Новый Фитол 2006 г.; 170:429-43; PMID: 16626466; http://dx.doi.org/10.1111/j.1469-8137.2006.01710.x [PubMed] [CrossRef] [Google Scholar]
38. Хокансон К.Е., Эллстранд Н.К., Уэдраого Дж.Т., Олвени П.А., Шаал Б.А., Рэйбоулд А.Ф. Биообогащенное сорго в Африке: использование формулировки проблемы для оценки риска. Нат Биотехнолог 2010 г.; 28:900-3; PMID: 20829822; http://dx.doi.org/10.1038/nbt0910-900 [PubMed] [CrossRef] [Google Scholar]
39.
де Йонг Т.Дж., Ронг Дж.
От урожая к дикому потоку генов: обеспечивают ли более сложные исследования более качественную оценку рисков?
Экологическая наука и политика
2013; 27:135-40; WOS:000316843500012; http://dx. doi.org/10.1016/j.envsci.2012.12.002 [CrossRef] [Google Scholar]
doi.org/10.1016/j.envsci.2012.12.002 [CrossRef] [Google Scholar]
40. Sayre R, Beeching JR, Cahoon EB, Egesi C, Fauquet C, Fellman J, Fregene M, Gruissem W, Mallowa S, Manary M, et al.. Программа BioCassava plus: биообогащение маниоки для стран Африки к югу от Сахары. Анну Рев Растение Биол 2011 г.; 62:251-72; PMID: 21526968; http://dx.doi.org/10.1146/annurev-arplant-042110-103751 [PubMed] [CrossRef] [Google Scholar]
41. Трипати Л. Биотехнология в Musa Improvement. In: Разведение бананов Прогресс и вызовы, Pillay M, Tenkuano A Eds, CRC Press 2011 г.; 219-36; http://dx.doi.org/10.1201/b10514-12 [CrossRef] [Google Scholar]
42. Селис К., Скурра М., Каугилл С., Чумбиаука С., Грин Дж., Франко Дж., Мейн Г., Кизебринк Д., Виссер Р.Г., Аткинсон Х.Дж. Экологическая биобезопасность и трансгенный картофель в центре разнообразия этой культуры. Природа 2004 г.; 432:222-5; PMID: 15538370; http://dx.doi.org/10.1038/nature03048 [PubMed] [CrossRef] [Google Scholar]
43. Чен Л., Лю Ю.Г. Восстановление мужской стерильности и фертильности сельскохозяйственных культур. Анну Рев Растение Биол
2014; 65:579-606; PMID: 24313845; http://dx.doi.org/10.1146/annurev-arplant-050213-040119
[PubMed] [CrossRef] [Google Scholar]
Чен Л., Лю Ю.Г. Восстановление мужской стерильности и фертильности сельскохозяйственных культур. Анну Рев Растение Биол
2014; 65:579-606; PMID: 24313845; http://dx.doi.org/10.1146/annurev-arplant-050213-040119
[PubMed] [CrossRef] [Google Scholar]
44. Moon HS, Li Y, Stewart CN, Jr. Сохранение джина в бутылке: трансгенное биосдерживание путем удаления пыльцы. Тенденции Биотехнологии 2010 г.; 28:3-8; PMID: 19857909; http://dx.doi.org/10.1016/j.tibtech.2009.09.008 [PubMed] [CrossRef] [Google Scholar]
45. Хюскен А., Прешер С., Шиманн Дж. Оценка стратегий биологического сдерживания опосредованного пыльцой потока генов. Экологическая биобезопасность Res 2010 г.; 9:67-73; PMID: 21288462; http://dx.doi.org/10.1051/ebr/2010009 [PubMed] [CrossRef] [Google Scholar]
46.
Омори С., Табучи Х., Ято О., Йошида Х. Агрономические признаки и способность содержать гены клейстогамных линий риса с мутацией superwoman1-cleistogamy. наука о породе
2012 г.; 62:124-32; PMID: 23136523; http://dx. doi.org/10.1270/jsbbs.62.124 [бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
doi.org/10.1270/jsbbs.62.124 [бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
47. Spillane C, Curtis MD, Grossniklaus U. Разработка технологии Apomixis — девственное рождение на фермерских полях? Нат Биотехнолог 2004 г.; 22:687-91; PMID: 15175691; http://dx.doi.org/10.1038/nbt976 [PubMed] [CrossRef] [Google Scholar]
48. Рифель ГЮ. Органические растения: генно-модифицированные растения, совместимые с органическим земледелием. Биотехнолог J 2012 г.; 7:1328-31; PMID: 22893621; http://dx.doi.org/10.1002/biot.201200225 [PubMed] [CrossRef] [Google Scholar]
49. Фрейтас Д.Ю., Нассар Н.М. Апомиксис в маниоке: достижения и проблемы. Жене Мол Рез 2013; 12:988-94; PMID: 23613244; http://dx.doi.org/10.4238/2013.April.2.14 [PubMed] [CrossRef] [Google Scholar]
50. Мур Г.А. Апельсины и лимоны: ключи к таксономии цитрусовых по молекулярным маркерам. Тенденции Жене 2001 г.; 17:536-40; PMID: 11525837; http://dx.doi.org/10.1016/S0168-9525(01)02442-8 [PubMed] [CrossRef] [Google Scholar]
51. Шкутник Т.
Апомиксис в системе воспроизводства сахарной свеклы. Acta Biologica Cracoviensia Серия Botanica
2010 г.; 52:87-96; WOS:000283386700011; http://dx.doi.org/10.2478/v10182-010-0011-y [CrossRef] [Google Scholar]
Шкутник Т.
Апомиксис в системе воспроизводства сахарной свеклы. Acta Biologica Cracoviensia Серия Botanica
2010 г.; 52:87-96; WOS:000283386700011; http://dx.doi.org/10.2478/v10182-010-0011-y [CrossRef] [Google Scholar]
52. Баркачча Г., Альбертини Э. Апомиксис в воспроизводстве растений: новый взгляд на старую дилемму. Репродукция растений 2013; 26:159-79; PMID: 23852378; http://dx.doi.org/ 10.1007/s00497-013-0222-y [бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
53. Sandhu S, Blount AR, Quesenberry KH, Altpeter F. Апомиксис и плоидный барьер подавляют опосредованный пыльцой поток генов в выращенных в полевых условиях трансгенных газонах и кормовых травах (Paspalum notatum Flugge). Теория Appl Genet 2010 г.; 121:919-29; PMID: 20512558; http://dx.doi.org/10.1007/s00122-010-1360-3 [PubMed] [CrossRef] [Google Scholar]
54.
Бикнелл Р.А., Колтунов А.М. Понимание апомиксиса: последние достижения и остающиеся загадки. Растительная клетка
2004 г.; 16
Приложение:S228-45; PMID: 15131250; http://dx. doi.org/10.1105/tpc.017921 [бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
doi.org/10.1105/tpc.017921 [бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
55. Strauss A, Lahaye T. Цинковые пальцы, эффекторы TAL или ДНК-связывающие белки на основе Cas9: что лучше всего подходит для нацеливания на желаемые локусы генома? Молекулярный завод 2013; 6:1384-87; PMID: 23718948; http://mplant.oxfordjournals.org/content/6/5/1384.short [PubMed] [Google Scholar]
56. Саураб С., Видьярти А.С., Прасад Д. РНК-интерференция: от концепции к реальности в улучшении урожая. Планта 2014; 239:543-64; PMID: 24402564; http://dx.doi.org/10.1007/s00425-013-2019-5 [PubMed] [CrossRef] [Google Scholar]
57. Мейер Р.С., Purugganan MD. Эволюция видов сельскохозяйственных культур: генетика одомашнивания и диверсификации. Нат Рев Жене 2013; 14:840-52; PMID: 24240513; http://dx.doi.org/10.1038/nrg3605 [PubMed] [CrossRef] [Google Scholar]
58.
Хантер П. «Генетически модифицированный облегченный» успокаивает общественность, но не активистов: новые технологии манипулирования геномами растений могут помочь преодолеть озабоченность общественности по поводу ГМ-культур. Представитель EMBO
2014; 15:138-41; PMID: 24451237; http://dx.doi.org/10.1002/embr.201338365 [бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
Представитель EMBO
2014; 15:138-41; PMID: 24451237; http://dx.doi.org/10.1002/embr.201338365 [бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
59. Гай Т., Герсбах К.А., Барбас К.Ф., III. Методы геномной инженерии на основе ZFN, TALEN и CRISPR/Cas. Тенденции Биотехнологии 2013; 31:397-405; PMID: 23664777; http://dx.doi.org/10.1016/j.tibtech.2013.04.004 [бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
60. Малига П. Преобразование пластид у высших растений. Анну Рев Растение Биол 2004 г.; 55:289-313; PMID: 15377222; http://dx.doi.org/10.1146/annurev.arplant.55.031903.141633 [PubMed] [CrossRef] [Google Scholar]
61. Moon HS, Abercrombie LL, Eda S, Blanvillain R, Thomson JG, Ow DW, Stewart CN, Jr. Вырезание трансгена в пыльце с использованием кодон-оптимизированной системы рекомбинации серин-резольвазы CinH-RS2, специфичной для сайта. Растение Мол Биол 2011 г.; 75:621-31; PMID: 21359553; http://dx.doi.org/10.1007/s11103-011-9756-2 [PubMed] [CrossRef] [Google Scholar]
62. Hu Z, Ding X, Hu S, Sun Y, Xia L. Тканеспецифически регулируемое сайт-специфическое удаление селективных маркерных генов в двухвалентном инсектицидном генетически модифицированном рисе. Биотехнолог Летт
2013; 35:2177-83; PMID: 23974493; http://dx.doi.org/10.1007/s10529-013-1310-7 [PubMed] [CrossRef] [Google Scholar]
Hu Z, Ding X, Hu S, Sun Y, Xia L. Тканеспецифически регулируемое сайт-специфическое удаление селективных маркерных генов в двухвалентном инсектицидном генетически модифицированном рисе. Биотехнолог Летт
2013; 35:2177-83; PMID: 23974493; http://dx.doi.org/10.1007/s10529-013-1310-7 [PubMed] [CrossRef] [Google Scholar]
63. Van Acker RC, Szumgalski AR, Friesen LF. Потенциальные выгоды, риски и затраты на генетические технологии ограничения использования. Can J Plant Sci 2007 г.; 87:753-62; WOS:000251635700008; http://dx.doi.org/10.4141/CJPS06033 [CrossRef] [Google Scholar]
64. Грессель Дж., Вальверде Б.Е. Стратегия обеспечения долгосрочной борьбы с сорным рисом при одновременном снижении потока трансгенов, устойчивых к гербицидам, и его потенциальное использование для других культур с родственными сорняками. Наука о борьбе с вредителями 2009 г.; 65:723-31; PMID: 19367567; http://dx.doi.org/10.1002/ps.1754 [PubMed] [CrossRef] [Google Scholar]
65.
Санг Ю, Милвуд Р. Дж., Стюарт К.Н.
Технологии ограничения использования генов для биоконфайнмента трансгенных растений. Журнал биотехнологии растений
2013; 11:649-58; WOS:00032298
Дж., Стюарт К.Н.
Технологии ограничения использования генов для биоконфайнмента трансгенных растений. Журнал биотехнологии растений
2013; 11:649-58; WOS:00032298
02; http://dx.doi.org/10.1111/pbi.12084 [PubMed] [CrossRef] [Google Scholar]
66. Gressel J. Тандемные конструкции: предотвращение роста суперсорняков. Тенденции Биотехнологии 1999 г.; 17:361-6; PMID: 10461182; http://dx.doi.org/10.1016/S0167-7799(99)01340-2 [PubMed] [CrossRef] [Google Scholar]
67. Аль-Ахмад Х., Грессель Дж. Смягчение с использованием тандемной конструкции, содержащей селективно непригодный ген, препятствует установлению трансгенов Brassica napus в гибридах и обратных скрещиваниях с сорной Brassica rapa. Завод Биотехнолог J 2006 г.; 4:23-33; PMID: 17177782; http://dx.doi.org/10.1111/j.1467-7652.2005.00153.x [PubMed] [CrossRef] [Google Scholar]
68.
Lin C, Fang J, Xu X, Zhao T, Cheng J, Tu J, Ye G, Shen Z. Встроенная стратегия сдерживания трансгенных растений: создание селективно терминируемого трансгенного риса. ПЛОС ОДИН
2008 г.; 3:е1818; PMID: 18350155; http://dx.doi.org/10.1371/journal.pone.0001818 [бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
ПЛОС ОДИН
2008 г.; 3:е1818; PMID: 18350155; http://dx.doi.org/10.1371/journal.pone.0001818 [бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
69. Liu C, Li J, Gao J, Shen Z, Lu BR, Lin C. Встроенный механизм для смягчения распространения трансгенов устойчивости к насекомым и гербицидам в сорных популяциях риса. ПЛОС ОДИН 2012 г.; 7:е31625; PMID: 22359609; http://dx.doi.org/10.1371/journal.pone.0031625 [бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
70. Li J, Yu H, Zhang F, Lin C, Gao J, Fang J, Ding X, Shen Z, Xu X. Встроенная стратегия предотвращения распространения трансгенов из генетически модифицированной кукурузы. ПЛОС ОДИН 2013; 8:е81645; PMID: 24324711; http://dx.doi.org/10.1371/journal.pone.0081645 [бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
71. Кейн Н.К., Баак Э.Дж. Происхождение сорного риса. Мол Эколь 2007 г.; 16:4423-25; PMID: 17850268; http://dx.doi.org/10.1111/j.1365-294X.2007.03520.x [PubMed] [CrossRef] [Google Scholar]
72. Sudianto E, Beng-Kah S, Ting-Xiang N, Saldain NE, Scott RC, Burgos NR.
Рис Clearfield (R): его развитие, успех и основные проблемы в глобальной перспективе. Защита урожая
2013; 49:40-51; http://www.sciencedirect.com/science/article/pii/S0261219413000495 [Google Scholar]
Sudianto E, Beng-Kah S, Ting-Xiang N, Saldain NE, Scott RC, Burgos NR.
Рис Clearfield (R): его развитие, успех и основные проблемы в глобальной перспективе. Защита урожая
2013; 49:40-51; http://www.sciencedirect.com/science/article/pii/S0261219413000495 [Google Scholar]
73. Шиврайн В.К., Бургос Н.Р., Гили Д.Р., Продажи М.А., Смит К.Л. Поток генов от сорного красного риса (Oryza sativa L.) к культивируемому рису и пригодность гибридов. Наука о борьбе с вредителями 2009 г.; 65:1124-29; PMID: 19530257; http://dx.doi.org/10.1002/ps.1802 [PubMed] [CrossRef] [Google Scholar]
74. Song X, Wang Z, Qiang S. Агрономические характеристики гибридов F1, F2 и F3 между сорным рисом и трансгенным рисом, устойчивым к глюфосинату. Наука о борьбе с вредителями 2011 г.; 67:921-31; ; http://dx.doi.org/10.1002/ps.2132 [PubMed] [CrossRef] [Google Scholar]
75.
Гейнс Т.А., Генри В.Б., Бирн П.Ф., Вестра П., Ниссен С.Дж., Шейнер Д.Л.
Козырь членистый (Aegilops cylindrica) путем гибридизации пшеницы, устойчивой к имидазолинону, в полевых условиях. Наука о сорняках
2008 г.; 56:32-6; http://dx.doi.org/10.1614/WS-07-033.1 [CrossRef] [Google Scholar]
Наука о сорняках
2008 г.; 56:32-6; http://dx.doi.org/10.1614/WS-07-033.1 [CrossRef] [Google Scholar]
76. Перес-Джонс А., Мартинс Б.А.Б., Мэллори-Смит К.А. Гибридизация в коммерческом поле между устойчивой к имидазолинону озимой пшеницей и козлиной (aegilops cylindrica) приводит к опосредованному пыльцой потоку генов imi1. Наука о сорняках 2010 г.; 58:395-401; http://dx.doi.org/10.1614/WS-D-10-00027.1 [CrossRef] [Google Scholar]
77. МакГиннис Э.Э., Мейер М.Х., Смит А.Г. Кисло-сладкий: научный и юридический взгляд на устойчивую к гербицидам сахарную свеклу. Растительная клетка 2010 г.; 22:1653-7; PMID: 20581306; http://dx.doi.org/10.1105/tpc.110.077198 [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
78.
Фенар С., Аустерлиц Ф., Куген Дж., Арно Дж. Ф. Поток генов, опосредованный пыльцой, на большие расстояния на уровне ландшафта: свекла-сорняк в качестве примера. Мол Эколь
2007 г.; 16:3801-13; PMID: 17850547; http://dx.doi.org/10.1111/j.1365-294X.2007. 03448.x [PubMed] [CrossRef] [Google Scholar]
03448.x [PubMed] [CrossRef] [Google Scholar]
79. Саджи Х., Накадзима Н., Аоно М., Тамаоки М., Кубо А., Вакияма С., Хатасэ Ю., Нагацу М. Наблюдение за побегом трансгенного масличного рапса вокруг японских портов и обочин дорог. Исследования экологической биобезопасности 2005 г.; 4:217-22; PMID: 16827549; http://dx.doi.org/10.1051/ebr:2006003 [PubMed] [CrossRef] [Google Scholar]
80. Аоно М., Вакияма С., Нагацу М., Накадзима Н., Тамаоки М., Кубо А., Саджи Х. Обнаружение дикого трансгенного масличного рапса с множественной устойчивостью к гербицидам в Японии. Экологическая биобезопасность Res 2006 г.; 5:77-87; PMID: 17328854; http://dx.doi.org/10.1051/ebr:2006017 [PubMed] [CrossRef] [Google Scholar]
81.
Нисидзава Т., Накадзима Н., Аоно М., Тамаоки М., Кубо А., Саджи Х. Мониторинг распространения генетически модифицированного масличного рапса вдоль обочины японской дороги: 3-летние наблюдения. Экологическая биобезопасность Res
2009 г.; 8:33-44; PMID: 19419652; http://dx. doi.org/10.1051/ebr/2009001 [PubMed] [CrossRef] [Google Scholar]
doi.org/10.1051/ebr/2009001 [PubMed] [CrossRef] [Google Scholar]
82. Кавата М., Мураками К., Исикава Т. Распространение и сохранение генетически модифицированного рапса вокруг гаваней Японии. Environ Sci Pollut Res Int 2009 г.; 16:120-6; PMID: 19050951; http://dx.doi.org/10.1007/s11356-008-0074-4 [PubMed] [CrossRef] [Google Scholar]
83. Мидзугути А., Йошимура Ю., Шибайке Х., Мацуо К. Сохранение диких популяций Brassica napus, происходящих из разбросанных семян вокруг морского порта Касима в Японии. Ежеквартальный журнал сельскохозяйственных исследований Jarq-Japan 2011 г.; 45:181-5; http://dx.doi.org/ 10.6090/jarq.45.181 [CrossRef] [Google Scholar]
84.
Аоно М., Вакияма С., Нагацу М., Канеко Ю., Нисидзава Т., Накадзима Н., Тамаоки М., Кубо А., Саджи Х. Семена возможного природного гибрида между устойчивыми к гербицидам Brassica napus и Brassica rapa обнаружены на берегу реки в Японии. гмкропс
2011 г.; 2:201-10; PMID: 22179196; http://dx.doi.org/10.4161/gmcr.2.3. 18931 [PubMed] [CrossRef] [Google Scholar]
18931 [PubMed] [CrossRef] [Google Scholar]
85. Бекки Х.Дж., Уорвик С.И., Наир Х., Сегин-Шварц Г.С. Поток генов на коммерческих полях устойчивого к гербицидам канолы (Brassica napus). Экологические приложения 2003 г.; 13:1276-94; http://www.jstor.org/stable/4134713 [Google Scholar]
86. Фризен Л.Ф., Нельсон А.Г., Ван Акер Р.К. Доказательства заражения посевных участков племенного канолы (Brassica napus) в западной Канаде генетически модифицированными признаками устойчивости к гербицидам. Агрономический журнал 2003 г.; 95:1342-7; http://dx.doi.org/10.2134/agronj2003.1342 [CrossRef] [Google Scholar]
87. Книспель А.Л., Маклахлан С.М., Ван Акер Р.С., Фризен Л.Ф. Поток генов и множественная устойчивость к гербицидам в уцелевших популяциях канолы. Наука о сорняках 2008 г.; 56:72-80; http://dx.doi.org/10.1614/WS-07-097.1 [CrossRef] [Google Scholar]
88.
Шафер М.Г., Росс А.А., Лондо Дж.П., Бердик К.А., Ли Э.Х., Трэверс С.Е., Ван де Уотер П.К., Сейгерс К.Л. Создание генетически модифицированных популяций канолы в США PLoS ONE
2011 г. ; 6:е25736; PMID: 21998689; http://dx.doi.org/10.1371/journal.pone.0025736 [бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
; 6:е25736; PMID: 21998689; http://dx.doi.org/10.1371/journal.pone.0025736 [бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
89. Yoshimura Y, Beckie HJ, Matsuo K. Трансгенный масличный рапс вдоль транспортных путей и порта Ванкувер в западной Канаде. Экологическая биобезопасность Res 2006 г.; 5:67-75; PMID: 17328853; http://dx.doi.org/10.1051/ebr:2006019[PubMed] [CrossRef] [Google Scholar]
90. Уорвик С.И., Симард М.Дж., Лежер А., Бекки Х.Дж., Браун Л., Чжу Б., Мейсон П., Сегин-Шварц Г., Стюарт К.Н. Гибридизация трансгенной Brassica napus L. и ее диких родственников: Brassica rapa L., Raphanus raphanistrum L., Sinapis arvensis L. и Erucastrum gallicum (Willd.) OE Schulz. Теоретическая и прикладная генетика 2003 г.; 107:528-39; WOS:000185004200017; http://dx.doi.org/10.1007/s00122-003-1278-0 [PubMed] [CrossRef] [Google Scholar]
91.
Симард М.Дж., Лежер А., Уорик С.И.
Трансгенные поля Brassica napus и сорняки Brassica rapa в Квебеке: симпатрия и гибридизация сорных культур in situ. Канадский журнал ботаники-Revue Canadienne de Botanique
2006 г.; 84:1842-51; http://www.ingentaconnect.com/content/nrc/cjb/2006/00000084/00000012/art00010 [Академия Google]
Канадский журнал ботаники-Revue Canadienne de Botanique
2006 г.; 84:1842-51; http://www.ingentaconnect.com/content/nrc/cjb/2006/00000084/00000012/art00010 [Академия Google]
92. Warwick SI, Legere A, Simard MJ, James T. Сохраняются ли сбежавшие трансгены в природе? Случай трансгена устойчивости к гербицидам в сорной популяции Brassica rapa. Мол Эколь 2008 г.; 17:1387-95; PMID: 17971090; http://dx.doi.org/10.1111/j.1365-294X.2007.03567.x [PubMed] [CrossRef] [Google Scholar]
93. Квист Д., Чапела IH. Трансгенная ДНК введена в традиционные местные сорта кукурузы в Оахаке, Мексика. Природа 2001 г.; 414:541-3; PMID: 11734853; http://dx.doi.org/doi: 10.1038/35107068 [PubMed] [CrossRef] [Google Scholar]
94.
Серратос-Эрнандес Х.А., Гомес-Оливарес Х.Л., Салинас-Арреортуа Н., Буэндиа-Родригес Э., Ислас-Гутьеррес Ф., Де-Ита А.
Трансгенные белки кукурузы в почвенном заповеднике Федерального округа, Мексика. Границы экологии и окружающей среды
2007 г.; 5:247-52; http://dx.doi. org/ 10.1890/1540-9295(2007)5[247:TPIMIT]2.0.CO;2 [CrossRef] [Google Scholar]
org/ 10.1890/1540-9295(2007)5[247:TPIMIT]2.0.CO;2 [CrossRef] [Google Scholar]
95. Мерсер К.Л., Уэйнрайт Д.Д. Поток генов от трансгенной кукурузы к местным сортам в Мексике: анализ. Сельское хозяйство, экосистемы и окружающая среда 2008 г.; 123:109-15; http://dx.doi.org/10.1016/j.agee.2007.05.007 [CrossRef] [Google Scholar]
96. Пинейро-Нельсон А., Ван Херваарден Дж., Пералес Х.Р., Серратос-Эрнандес Дж.А., Рангель А., Хаффорд М.Б., Гептс П., Гарай-Арройо А., Ривера-Бустаманте Р., Альварес-Буйлла Э.Р. Трансгены в мексиканской кукурузе: молекулярные данные и методологические соображения для обнаружения ГМО в популяциях местных сортов. Мол Эколь 2009 г.; 18:750-61; PMID: 19143938; http://dx.doi.org/10.1111/j.1365-294X.2008.03993.x [бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
97.
Zapiola ML, Campbell CK, Butler MD, Mallory-Smith CA.
Побег и укоренение трансгенной устойчивой к глифосату полевицы ползучей Agrostis stolonifera в Орегоне, США: 4-летнее исследование. Журнал прикладной экологии
2008 г.; 45:486-94; WOS:000254192500011; http://dx.doi.org/10.1111/j.1365-2664.2007.01430.x [CrossRef] [Google Scholar]
Журнал прикладной экологии
2008 г.; 45:486-94; WOS:000254192500011; http://dx.doi.org/10.1111/j.1365-2664.2007.01430.x [CrossRef] [Google Scholar]
98. Ватруд Л.С., Ли Э.Х., Фэйрбразер А., Бердик С., Райхман Дж.Р., Боллман М., Сторм М., Кинг Г., Ван де Уотер П.К. Доказательства опосредованного пыльцой потока генов на ландшафтном уровне от генетически модифицированной ползучей полевицы с CP4 EPSPS в качестве маркера. Proc Natl Acad Sci U S A 2004 г.; 101:14533-8; PMID: 15448206; http://dx.doi.org/10.1073/pnas.0405154101 [бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
99. Элстранд, Северная Каролина. Более десяти лет трансгенов сельскохозяйственных культур неуместны. В: Возняк СА. и МакХьюген А., редакторы. Регулирование сельскохозяйственной биотехнологии: Соединенные Штаты и Канада, Springer Science+Business Media Dordrecht; 2012. [Google Scholar]
100.
Бауэр-Панскус А, Бреклинг Б, Хамбергер С, Затем С.
Независимая от культивирования установка генно-инженерных растений в естественных популяциях: текущие данные и последствия для регулирования ЕС.

